Plagas tolerantes a la fosfina y su manejo con buenas prácticas de fumigación
La tolerancia a la fosfina en insectos se genera por fumigaciones mal realizadas, dosis no adecuadas, tiempos de exposición cortos, bajo nivel de hermeticidad y no realizar mediciones durante la fumigación, entre otros.
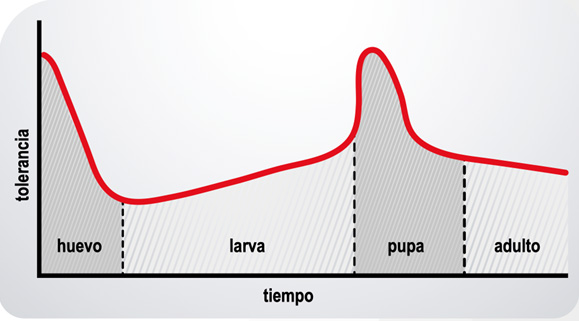
Los insectos normalmente presentan tolerancia a la fosfina dependiendo del estado de desarrollo en el que se encuentran, siendo el huevo y pupa los que mayor tolerancia presentan y larva y adulto los que presentan menor tolerancia, esto se debe al metabolismo respiratorio.
Las fumigaciones a niveles sub-letales (menos de la concentración estipulada en la etiqueta) puede producir efectos de alteración en los niveles de tolerancia. Los insectos tratados con fosfina en los silos, bodegas y otro tipo de estructuras pueden estar expuestos a concentraciones bajas y permitir que la mayoría de los insectos sobrevivan, generando descendencia tolerante a la fosfina.
Insectos con tolerancia a la fosfina
Se han reportado algunos insectos con tolerancia a la fosfina en diversos países. Este se observó con Tribolium castaneum y fosfina en 1969. También han presentado resistencia a la fosfina Sitophilus spp, Trogoderma granarium y Cryptolestes ferrugineus (Hole, et. al., 1976). En 1998 se identificó en Rhyzopertha dominica niveles de tolerancia a la fosfina, al igual que en Psócido.




Existe fuerte evidencia de que la fosfina interrumpe el metabolismo energético, particularmente en la función mitocondrial. La estructura de la membrana de la mitocondria es critica para la función energética de la célula y representa una barrera interna para la captación de fosfina. Solamente puede ingresar si se rompe físicamente la membrana o a través de la membrana interna de la mitocondria (Nath, et. al., 2011).
Los genes que se activan ante el estímulo generado por la fosfina son responsables de la tolerancia. Por ejemplo, en Rhyzopertha dominica se han identificado dos genes que le confieren tolerancia hasta 25 veces más que una cepa con niveles normales (Schlipalius, et. al., 2006).
En Tribolium castaneum, la tolerancia a la fosfina está codificada por dos genes que individualmente les confieren una mínima tolerancia, pero en conjunto puede generar tolerancias de hasta 431 veces mayor (Jagadeesan, et. al., 2012).
Para Cryptolestes ferrugineus se ha reportado tolerancia a la fosfina de hasta 133.5 veces más que cepas de la misma especie que no muestran esta característica (Konemann, et. al. 2017).
Buenas prácticas de fumigación
Realizar las Buenas Prácticas de Fumigación (BPF) ayudará a controlar las especies de insectos tolerantes a fosfina, por esto es recomendable seguir las siguientes 5 recomendaciones:
1) Identificación de la especie de insecto, ya que dependiendo de la especie presente en la mercancía a fumigar y estados de desarrollo se deberá de determinar las dosis y tiempos de exposición, además del fumigante que se deberá de aplicar.
2) Dosis, deben de corresponder a las estipuladas en la etiqueta de Phostoxin® y Placas Degesch®, ya que subdosificar nos podría llevar a generar cepas tolerantes a fosfina de las diferentes especies de insectos.
3) Tiempo de exposición, deberá de ser de por al menos 72 horas en especies como Sitophilus spp., Oryzaephilus surinamensis, Acanthoscelides obtectus, Plodia interpunctella, Lasioderma serricorne y más de 96 horas en especies como Cryptolestes ferrugineus, Rhizopertha dominica, Tribolium castaneum, Trogoderma granarium.
4) La hermetización del espacio a fumigar también es de suma importancia, ya que si existe pérdida de fosfina podremos tener problemas de subdosificación.
5) Medición de la concentración de fosfina con el equipo X-am® 5000 para fosfina, ya que con esos datos podremos tener la certeza de que la curva de liberación y concentración en todo el espacio a fumigar se lleva a cabo de manera esperada, si encontramos que tenemos pérdidas de la dosis de fosfina aplicada, se puede realizar otra aplicación, esto es solamente es posible con los equipos Axelerator®.
La concentración de fosfina deberá de monitorearse durante las primeras 12 horas cada 2 horas y, posteriormente, cada 12 horas en mínimo 3 puntos y esto depende del espacio a fumigar.
Referencias:
- Hole, B. D., Bell, C. H., Mills, K. A., & Goodship, G. (1976). The toxicity of phosphine to all developmental stages of thirteen species of stored product beetles. Journal of Stored Products Research, 12(4), 235-244.
- Nath, N. S., Bhattacharya, I., Tuck, A. G., Schlipalius, D. I., & Ebert, P. R. (2011). Mechanisms of phosphine toxicity. Journal of toxicology, 2011.
- Schlipalius, D., Collins, P. J., Mau, Y., & Ebert, P. R. (2006). New tools for management of phosphine resistance. Outlooks on Pest Management, 17(2), 52-56.
- Jagadeesan, R., Collins, P. J., Daglish, G. J., Ebert, P. R., & Schlipalius, D. I. (2012). Phosphine resistance in the rust red flour beetle, Tribolium castaneum (Coleoptera: Tenebrionidae): inheritance, gene interactions and fitness costs. PLos one, 7(2), e31582.
- Konemann, C. E., Hubhachen, Z., Opit, G. P., Gautam, S., & Bajracharya, N. S. (2017). Phosphine resistance in Cryptolestes ferrugineus (Coleoptera: Laemophloeidae) collected from grain storage facilities in Oklahoma, USA. Journal of Economic Entomology, 110(3), 1377-1383.
1 Comentario
Enviar un comentario
Lo más popular
La fumigación orgánica con Atmosferas Modificadas (MAP) controla insectos en TODAS sus fases sin residuos químicos
En el almacenamiento de granos, la plaga rara vez llega...
¿Control de plagas vs. fumigación? Conoce la diferencia.
En el manejo integrado de plagas, es común confundir...
Ventajas de las Placas Degesch para el control de plagas
¿Alguna vez te has preguntado qué es lo que hay detrás...






Excelente, de suma importancia la información, fortalece los conocimientos y actualiza innovaciones que permite estar a la vanguardia en esta importante actividad.